Salmonella Typhimurium / © NIAID, flickr Колоректальный рак — один из самых смертельных видов онкологии в мире, который плохо поддается лечению. Исследователи из Медицинской школы Йонг Лу Линь Национального университета Сингапура (National University of Singapore’s Yong Loo Lin School of Medicine) и Центрально-Южного университета Китая (Central South University) изучили возможность лечения колоректального рака с помощью стимуляции специальных кластеров иммунных клеток — зрелых третичных лимфоидных структур (mTLS).
Они образуются вблизи опухолей и связаны с улучшением показателя выживаемости. Исследование опубликовано в журнале Science Translational Medicine. В начале ученые использовали ослабленный штамм «Сальмонелла тифимуриум», ранее доказавший свою безопасность при испытаниях на людях при других формах онкологии. Этот штамм естественным образом проникает в опухоли. Исследователи создали бактерии, добавив схему синхронизированного лизиса (SLC). Бактерии начинали самоуничтожаться, едва достигнув высокой плотности внутри опухолей. Разрушаясь, бактерии высвобождают белок LIGHT. Этот белок связывается с рецептором HVEM на иммунных клетках, вызывая сильную иммунную активацию. Терапию протестировали на двух типах мышей, склонных к колоректальному раку. Первый тип — генетическая модель мышей, у которых опухоли кишечника развиваются естественным образом. Второй тип — химической модели, у которых рак индуцировали с помощью химических веществ. Ученые проанализировали изменения во врожденных иммунных клетках, особенно в ILC3, Т-клетках и наличие зрелых третичных лимфоидных структур (mTLS). ILC3 — врожденного лимфоидные клетки 3-й группы. Они очень важны для поддержания здоровья в барьерных тканях, таких как кишечник и легкие. При колоректальном раке защитные клетки ILC3 превращаются в менее полезные клетки ILC1. Использование модифицированной Сальмонеллы при лечении позволило обратить этот эффект вспять. Количество ILC3 увеличивалось, а ILC1 уменьшалось. Использование обычного вида Сальмонеллы усиливало образование третичных лимфоидных структур (TLS), но они не созревали до уровня, достаточного для сильной борьбы с опухолями. Терапия, высвобождающая LIGHT, не только увеличивала TLS, но и «повышала» их до уровня зрелых третичных лимфоидных структур (mTLS) с организованными B-клетками и T-клеточными зонами. Это считается признаком эффективных иммунных ниш — в этом участке опухоли иммунная система готова эффективно защищать организм. Терапия усиливала противоопухолевый иммунитет. CD8+ Т-клетки (Т-киллеры) работали активнее, продуцируя интерферон-гамма (IFN-γ), который стимулирует иммунные реакции и предотвращает повреждение тканей. Также они продуцировали гранзим B, который непосредственно вызывает запрограммированную гибель клеток (апоптоз) в целевых клетках для устранения рака или инфекции. Терапия значительно снижала рост опухоли. Показатель выживаемости был улучшен, а некоторые мыши достигли полного контроля над опухолью. Эффективность терапии зависела от наличия ILC3 и сигнального пути LIGHT-HVEM, который происходил благодаря разрушению бактерий. У мышей, лишенных рецептора HVEM или защитных клеток ILC3, терапия не работала. У них не созревали третичные лимфоидные структуры (TLS) и опухоль не уменьшалась. Стадия развития и структура TLS / © Science Translational Medicine Работа имеет некоторые ограничения. Ученые проводили исследование на мышах, а иммунная система и кишечная микробиота человека могут реагировать иначе. Модифицированные бактерии при распаде выделяют множество факторов, поэтому исследователи не могут точно определить, какие эффекты вызваны непосредственно белком LIGHT. Также ученые пока не могут точно сказать, какие подтипы ILC (разновидности врожденных лимфоидных клеток) наиболее важны для действия терапии. Не до конца изучено, какие именно цепочки реакций происходят, когда сигнальная молекула активируется, и как это влияет на иммунитет. Любая живая бактериальная терапия — риск непреднамеренной инфекции. Сложно спрогнозировать ее взаимодействие с микробиотой пациента. Однако, если такой метод покажет свою эффективность у людей, его можно использовать в качестве нового варианта лечения: модифицированные бактерии, поселившись в опухолях, прямо там будут выделять вещества, стимулирующие иммунитет. Эта терапия сможет дополнять другие виды лечения, делая опухоли колоректального рака более заметными для иммунной системы. В перспективе эту стратегию можно адаптировать для других видов рака, которые тяжело поддаются лечению.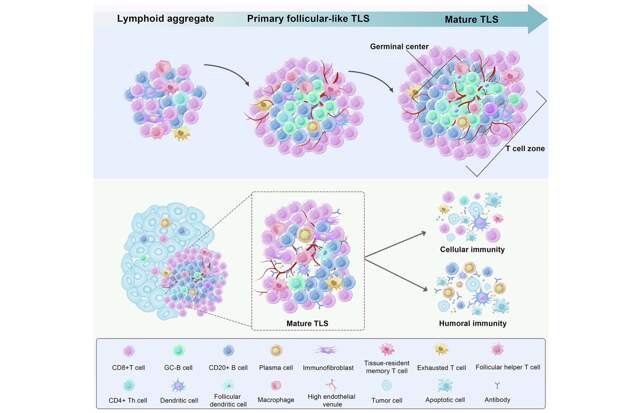
Свежие комментарии